Perchloroéthylène
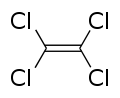
Le perchloroéthylène ou tétrachloroéthylène est un composé chimique de formule Cl 2 C=CCl 2. Il est quelquefois nommé simplement perchlo.

Catégories :
Produit chimique nocif - Produit chimique dangereux pour l'environnement - Cancérogène chimique - Chloroalcène - Solvant - Entretien des textiles - Textile
Recherche sur Google Images :
Source image : susty.com Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- ... Le perchloroéthylène est le solvant le plus fréquemment utilisé pour le nettoyage à sec. Il sert aussi à dégraisser les pièces métalliques... (source : fr.ekopedia)
- Le perchloroéthylène est un solvant essentiellement utilisé dans les pressing pour le nettoyage à sec des textiles (90% des quantités... (source : inrs)
- Le perchloroéthylène est un solvant essentiellement utilisé dans les pressing pour le nettoyage à sec des textiles (90% des quantités utilisées).... (source : arcane-industries)
| Perchloroéthylène | |||
|---|---|---|---|
 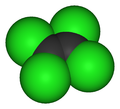 |
|||
| Général | |||
| Nom IUPAC | tétrachloroéthylène | ||
| No CAS | |||
| No EINECS | |||
| Apparence | liquide incolore, d'odeur caractéristique. [1] | ||
| Propriétés chimiques | |||
| Formule brute | C2Cl4 [Isomères] |
||
| Masse molaire[3] | 165, 833 ± 0, 01 g·mol-1 C 14, 49 %, Cl 85, 51 %, |
||
| Diamètre moléculaire | 0, 564 nm [2] | ||
| Propriétés physiques | |||
| T° fusion | -22 °C[1] | ||
| T° ébullition | 121 °C[1] | ||
| Solubilité | dans l'eau à 20 °C : 0, 15 g·l-1[1], soluble dans l'éthanol, l'acetone, le diéthyléther, le benzène, miscible avec le chloroforme |
||
| Masse volumique | 1, 6 g·cm-3[1] | ||
| Pression de vapeur saturante | à 20 °C : 1, 9 kPa[1] | ||
| Viscosité dynamique | 0, 89 cP at 25 °C | ||
| Thermochimie | |||
| Cp |
|
||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 9, 326 ± 0, 001 eV (gaz) [5] | ||
| Propriétés optiques | |||
| Indice de réfraction | 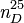 1, 503 [2] 1, 503 [2] |
||
| Précautions | |||
|
|
|||
|
|||
|
|
|||
| Phrases R : 40, 51/53, | |||
| Phrases S : 2, 23, 36/37, 61, [6] | |||
|
|
|||
|
|||
|
|
|||
|
|
|||
 |
|||
|
|
|||
  Attention |
|||
|
|
|||
| Groupe 2A : Certainement cancérogène pour l'homme[7] | |||
| Écotoxicologie | |||
| LogP | 2, 6[1] | ||
| DJA | 0, 014 mg/kg p. c. /jour[10] | ||
| Seuil de l'odorat | bas : 2 ppm haut : 71 ppm[11] |
||
|
|
|||
Le perchloroéthylène ou tétrachloroéthylène est un composé chimique de formule Cl2C=CCl2. Il est quelquefois nommé simplement perchlo.
Ce solvant, qui est un composé organique volatil, en particulier utilisé pour le nettoyage à sec de tissus et pour dégraisser des métaux. Il figure sur la liste des cancérogènes du groupe 2A du CIRC et peut causer des troubles neurologiques, rénaux et hépatiques..
Propriétés
À température ambiante, c'est un liquide ininflammable et inexplosible. Il s'évapore aisément dans l'air et a une odeur âcre. La majorité des gens peuvent sentir le perchloroéthylène dans l'air à partir d'une concentration d'1 ppm (partie par million). Certaines personnes peuvent le sentir à une concentration toujours plus basse.
Le perchloroéthylène est presque insoluble dans l'eau mais miscible dans la majorité des solvants organiques. Il est lipophile (attiré par la graisse) et dissout des substances telles que graisses, huiles ou résines.
Sa température de fusion est de -22 °C et sa température d'ébullition de 121 °C.
Il peut réagir violemment avec les métaux alcalins ou alcalino-terreux, les alcalis (soude et potasse) et l'aluminium.
Histoire
Le perchloroéthylène a été synthétisé pour la première fois en 1821 par Michæl Faraday. Il a chauffé de l'hexachloroéthane jusqu'à ce qu'il se décompose en perchloroéthylène et en chlore.
Production
La plupart du perchloroéthylène est produit à partir de l'éthylène en passant par le 1, 2-dichloroéthane. Lorsque du 1, 2-dichloroéthane (ClCH2-CH2Cl) est chauffé à 400 °C avec du chlore (Cl2), du perchloroéthylène est obtenu selon la réaction suivante :
ClCH2-CH2Cl + 3Cl2 --> Cl2C=CCl2 + 4HCl
Cette réaction peut être catalysée par un mélange de chlorure de potassium et de chlorure d'aluminium, ou par du charbon actif. Le trichloroéthylène est le principal sous-produit de cette réaction. Le perchloroéthylène et le trichloroéthylène, qui est aussi un solvant commercialisé, sont collectés ensemble puis scindés par distillation.
Il existe un autre procédé d'obtention moins courant à partir d'hydrocarbures légers partiellement chlorés, sous-produits de processus chimiques. Lorsque ces composés sont chauffés en présence de chlore en excès, ils donnent un mélange de perchloroéthylène, de tétrachlorométhane et de chlorure d'hydrogène.
Utilisation
En général, le perchloroéthylène est utilisé comme solvant. La majorité des composés organiques se dissolvent dans le perchloroéthylène. Le perchloroéthylène est le solvant le plus fréquemment utilisé pour le nettoyage à sec. Il sert aussi à dégraisser les pièces métalliques dans les industries automobile et métallurgique. On le trouve aussi dans quelques produits de consommation comme des solvants pour la peinture ou pour enlever les taches.
Avant leur interdiction pour cet usage [réf. nécessaire], le perchloroéthylène servait à la fabrication de réfrigérants au fréon.
Effets sur la santé
Dans l'Union européenne, le perchloréthylène est classé comme «nuisible à la santé» et «dangereux pour l'environnement» [12]. Il figure sur la liste des cancérogènes du groupe 2A du CIRC, qui inclut les produits certainement cancérigènes pour l'homme. Il est aussi inclus, en France, dans le tableau 12 RG des maladies professionnelles [13]
Le perchloroéthylène est absorbé par inhalation, par voie orale et par la peau (lorsqu'il est sous forme liquide). Il est toxique pour le système nerveux et le rein. L'exposition au tétrachloroéthylène peut causer une irritation des voies respiratoires et des yeux, des vertiges, nausées, maux de tête et pertes de mémoire, une somnolence et cela peut aller jusqu'à la perte de connaissance et la mort. Un cluster de cancer (leucémie et autres), impliquant des composés organiques volatiles dégagés par une entreprise de nettoyage à sec, dont du trichloréthylène, du 1, 2-dichloroéthylène, du perchloroéthylène, du dichlorométhane et du chlorure de vinyle, a été découvert à Camp Lejeune, en Caroline du Nord [14].
Selon le docteur Dolores Malaspina, directrice du département de psychiatrie de la New York University School of Medicine, il serait aussi un facteur schizophrénique : selon elle , les enfants exposés à du perchloroéthylène du fait du travail de leurs parents dans des centres de nettoyage à sec auraient 3, 5 fois plus de risque de développer des symptômes de schizophrénie [15]. Aussi, selon le docteur Malaspina, il est envisageable que Cho Seung-hui, le tueur de Virginia Tech, ait été affecté par ce produit, ses parents ayant une entreprise de nettoyage à sec [15].
Le Danemark et les États-Unis ont interdit l'installation de nouveaux pressings utilisant le perchloroéthylène, produit qui devrait être complètement retiré aux États-Unis en 2020 [12]. L'UE a engagé une politique de réduction du risque et des émissions de perchloroéthylène avec la directive 1999/13/CE relative à la réduction des émissions de composés organiques volatils dues à l'utilisation de solvants organiques dans certaines activités et installations [16]. En France, 15 000 personnes seraient exposés, au travail, au «perchlo» [12]. Les trois principales alternatives au perchloréthylène sont le nettoyage au mouillé, l'utilisation du Silicone Liquide (procédé GreenEarth), d'hydrocarbures et l'utilisation du dioxyde de carbone [16]. Parc Disneyland lave les textiles par du siloxane, un solvant non toxique à base d'hydrocarbures [12], qui est commercialisé sous la marque GreenEarth.
Lors de l'ouverture du hublot d'une machine de nettoyage à sec, les vapeurs de perchloroéthylène s'échappent de la machine. Les personnes œuvrant ou habitant au-dessus d'un pressing sont exposées à ces vapeurs. Les vapeurs de perchlorethylène peuvent traverser le béton et les planchers jusqu'à trois étages au-dessus du rez de chaussée. Les alentours des pressings au Perchlorethylène sont aussi fréquemment contaminés et sont dangereux pour les passants, clients et voisins des pressings au perchloréthylène. < André Cicollela>.
Il est recommandé de bien aérer les textiles qui ont été nettoyés à sec. En cas de contact du perchloréthylène avec la peau ou les yeux, rincer à grande eau et consulter un médecin.
Effets sur l'environnement
Le perchloroéthylène est dangereux pour l'environnement. Rejeté dans l'eau ou l'air, il se dégrade particulièrement lentement. Les machines de nettoyage à sec laissent échapper des vapeurs de perchloréthylène dans l'air et produisent des boues chargées de perchloréthylène qui peuvent être recyclées mais partent fréquemment dans les égouts. Rejeté dans l'eau, le perchloréthylène perturbe le fonctionnement des stations d'épuration et est toxique pour les organismes aquatiques. [17]
Ce solvant fait partie des composés organiques volatils (COV) : il intervient dans la production d'ozone à basse atmosphère.
Normes, seuils
- En France :
la valeur-guide de qualité de l'air intérieur (VGAI) mise à jour par l'AFSSET [18] en 2010 est :
- - 1380 µg. m-3 pour les expositions de courte durée
- - 250 μg. m-3. pour les expositions de longue durée
L'observatoire de la qualité de l'air intérieur signalait en 2006 que le taux habituel dans l'air intérieur était de quelques μg. m-3, mais que des taux de plusieurs milliers de µg. m-3 ont été mesurées dans certains logements localisés au dessus de pressings [18].
Notes
- TETRACHLORŒTHYLENE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, John Wiley & Sons Ltd, England, 1999, 239 p. (ISBN 0-471-98369-1)
- Masse molaire calculée selon Atomic weights of the elements 2007 sur www. chem. qmul. ac. uk
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, 2 et 3, Gulf Pub. Co., Huston, Texas, 1996 (ISBN 0-88415-857-8, ISBN 0-88415-858-6, ISBN 0-88415-859-4)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd. , 2736 p. (ISBN 9781420066791) , p. 10-205
- «tétrachloroéthylène» sur ESIS, consulté le 22 février 2009
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, «Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2A : Certainement cancérogènes pour l'homme» sur http ://monographs. iarc. fr, CIRC, 16 janvier 2009. Consulté le 22 août 2009
- «Perchloroéthylène» dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Concentrations/doses journalières acceptables et concentrations/doses tumorigènes des substances d'intérêt prioritaire calculées selon critères sanitaires, publié par Santé Canada
- Tetrachlorœthylene sur hazmap. nlm. nih. gov. Consulté le 14 novembre 2009
- Ophélie Neiman, Les risques de «cancer du pressing» sous-évalués en France, Rue 89, 22 mai 2007 (Entretien avec André Cicolella), page consultée le 22 mai 2007)
- Voir aussi Dichlorométhane (maladie professionnelle) .
- Agency for Toxic Substances and Disease Registry (ATSDR), Survey of Childhood Cancers and Birth Defects at USMC Camp Lejeune (Full Report) , juillet 2003.
- Kesner, Julian, Toxic fumes may have made gunman snap, New York Daily News, 20 avril 2007.
- INERIS, Note sur les produits de substitution du perchloroéthylène dans les installations de nettoyage à sec. Analyse de la réglementation et des pratiques à l'étranger, 2005.
- http ://www. univ-fcomte. fr/download/ufr_st/document/masters/docs_ess/m2/bioremediation
- Air intérieur : valeurs guides Affset, Avril 2010
Liens externes
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 16/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.




 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité